Que es uma, mol y cual es la relacion entre ambos. (CBC - Ingenieria/Exactas)
Back to learning
Created: 25/02/2012
Este es un pequeño tutorial sobre lo que es un mol, una uma y como se relacionan ambas cosas, cualquier incoherencia o error encontrado por favor haga click en 'Denounce (Denunciar)' e indique cual es el error cometido. Gracias.
Primero vamos aclarar brevemente que es mol: El mol es una unidad que mide cantidad de cierta sustancia, esta representado por la cantidad de atomos de 'Carbono-12' que hay en '12 gramos' del mismo Carbono o sea que 12 gramos de Carbono-12 contiene -> 6,022 141 79 (30) Ã 10 (a la 23) atomos de C-12
(Esto fue comprobado experimentalmente, puede leer mas informacion detallada e historica en wikipedia)
Uma: Unidad de masa atomica, es la medidad de masas atomicas y moleculares, equivale a la (1/12) parte de la masa de un atomo de Carbono-12.
Por que Carbono y por que estos numeros?, simplemente es un patron de referencia que se utiliza actualmente en base al cual podemos calcular la masa de los demas elementos,
"..La escala unificada, basada en el carbono-12, 12C, cumplÃa el requerimiento de los fÃsicos de basar la escala en un isótopo puro, a la vez que se hacÃa numéricamente cercana a la escala de los quÃmicos.."
lo puede leer mas claramente aca: http://es.wikipedia.org/wiki/Masa_at%C3%B3mica
Y cuanto pesa un atomo de carbono?, bueno para averiguar eso, ya sabemos que 12 gramos de C-12 contienen
6,022 141 79 (30) Ã 10 (a la 23) atomos, simplemente dividomos la masa/cantidad:
12gramos
6,022 141 79 (30) Ã 10 (a la 23)
--------------------------------
1,9926*10 (a la -23) 'Es la menos 23' gramos
Entonces si esto equivale al peso de un atomo de C-12, una UMA equivaldria a:
(1/12) * 1,9926*10 (a la -23) = 1,6605*10 (a la -24) gramos
Veamos un ejemplo:
Seleccionemos justamente el Carbono en nuestra tabla periodico.
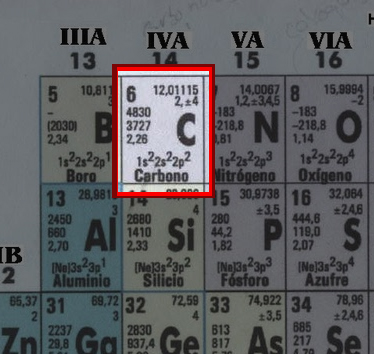
Vemos que dice 12,011 umas (se simboliza como 'u') en este caso es hacer la reversa de nuestra multiplicacion y sabremos cuanto pesa UN atomo de carbono:
12 umas * (1,6605*10 (a la -24) gramos) = 1,9926*10 (a la -23) gramos
Pero hay una cosa a tener en cuenta el mismo numero que representa umas coincide con la masa en gramos de 1 mol de un elemento determinado (no necesariamente Carbono), veamos por que?
Sabemos que un mol de atomos de C-12 contiene 6,022 141 79 (30) Ã 10 (a la 23) atomos entonces simplemente multiplicamos la cantidad de atomos por el peso de cada atomo:
6,022 141 79 (30) Ã 10 (a la 23) atomos * 1,9926*10 (a la -23) = 12 gramos/mol
Veamos otro ejemplo con otro elemento de la tabla:
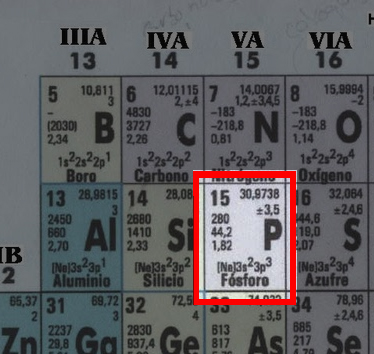
Hemos seleccionado al fosforo vemos claramente que la masa de un atomo de fosforo es casi 31 uma, lo que tambien quiere decir que un mol de fosforo pesa 31 gramos/mol, comprobemos lo dicho:
Un atomo de P
31 umas * el peso de 1 uma (1,6605*10 (a la -24) gramos) = 5,14*10 (a la -23) gramos - aprox
Y por que un mol de P pesa casi 31 gramos?
Cuanto pesa un atomo * Cuantos atomos de P hay en 1 mol = el peso de 1 mol de P.
5,14*10 (a la -23) gramos - aprox * 6,022 141 79 (30) Ã 10 (a la 23) = 31 gramos/mol
Entonces mirando la masa atomica de un elemento en la tabla periodica sabemos cuanto pesa 1 mol del mismo en gramos y por cuanto tenemos que multiplicar nuestro patron de referencia que es UMA para ver cuanto pesa un atomo de dicho elemento.
Si encontras algun error denuncia al documento!
Espero que le ayude a alguien. Saludos!
Cualquier cosa dejen comentario!
Este es un pequeño tutorial sobre lo que es un mol, una uma y como se relacionan ambas cosas, cualquier incoherencia o error encontrado por favor haga click en 'Denounce (Denunciar)' e indique cual es el error cometido. Gracias.
Primero vamos aclarar brevemente que es mol: El mol es una unidad que mide cantidad de cierta sustancia, esta representado por la cantidad de atomos de 'Carbono-12' que hay en '12 gramos' del mismo Carbono o sea que 12 gramos de Carbono-12 contiene -> 6,022 141 79 (30) Ã 10 (a la 23) atomos de C-12
(Esto fue comprobado experimentalmente, puede leer mas informacion detallada e historica en wikipedia)
Uma: Unidad de masa atomica, es la medidad de masas atomicas y moleculares, equivale a la (1/12) parte de la masa de un atomo de Carbono-12.
Por que Carbono y por que estos numeros?, simplemente es un patron de referencia que se utiliza actualmente en base al cual podemos calcular la masa de los demas elementos,
"..La escala unificada, basada en el carbono-12, 12C, cumplÃa el requerimiento de los fÃsicos de basar la escala en un isótopo puro, a la vez que se hacÃa numéricamente cercana a la escala de los quÃmicos.."
lo puede leer mas claramente aca: http://es.wikipedia.org/wiki/Masa_at%C3%B3mica
Y cuanto pesa un atomo de carbono?, bueno para averiguar eso, ya sabemos que 12 gramos de C-12 contienen
6,022 141 79 (30) Ã 10 (a la 23) atomos, simplemente dividomos la masa/cantidad:
12gramos
6,022 141 79 (30) Ã 10 (a la 23)
--------------------------------
1,9926*10 (a la -23) 'Es la menos 23' gramos
Entonces si esto equivale al peso de un atomo de C-12, una UMA equivaldria a:
(1/12) * 1,9926*10 (a la -23) = 1,6605*10 (a la -24) gramos
Veamos un ejemplo:
Seleccionemos justamente el Carbono en nuestra tabla periodico.

Vemos que dice 12,011 umas (se simboliza como 'u') en este caso es hacer la reversa de nuestra multiplicacion y sabremos cuanto pesa UN atomo de carbono:
12 umas * (1,6605*10 (a la -24) gramos) = 1,9926*10 (a la -23) gramos
Pero hay una cosa a tener en cuenta el mismo numero que representa umas coincide con la masa en gramos de 1 mol de un elemento determinado (no necesariamente Carbono), veamos por que?
Sabemos que un mol de atomos de C-12 contiene 6,022 141 79 (30) Ã 10 (a la 23) atomos entonces simplemente multiplicamos la cantidad de atomos por el peso de cada atomo:
6,022 141 79 (30) Ã 10 (a la 23) atomos * 1,9926*10 (a la -23) = 12 gramos/mol
Veamos otro ejemplo con otro elemento de la tabla:

Hemos seleccionado al fosforo vemos claramente que la masa de un atomo de fosforo es casi 31 uma, lo que tambien quiere decir que un mol de fosforo pesa 31 gramos/mol, comprobemos lo dicho:
Un atomo de P
31 umas * el peso de 1 uma (1,6605*10 (a la -24) gramos) = 5,14*10 (a la -23) gramos - aprox
Y por que un mol de P pesa casi 31 gramos?
Cuanto pesa un atomo * Cuantos atomos de P hay en 1 mol = el peso de 1 mol de P.
5,14*10 (a la -23) gramos - aprox * 6,022 141 79 (30) Ã 10 (a la 23) = 31 gramos/mol
Entonces mirando la masa atomica de un elemento en la tabla periodica sabemos cuanto pesa 1 mol del mismo en gramos y por cuanto tenemos que multiplicar nuestro patron de referencia que es UMA para ver cuanto pesa un atomo de dicho elemento.
Si encontras algun error denuncia al documento!
Espero que le ayude a alguien. Saludos!
Cualquier cosa dejen comentario!